日本におけるポジトロン断層 (PET) 装置の研究開発のあゆみ
― 初めてのPET画像から25年目を迎えて ―
菅野 巌 秋田脳研
2004年は日本で初めてPET装置が開発され最初のPET画像が得られてからちょうど25年目に当たる。当時PET装置の開発は放射線医学総合研究所(放医研)と秋田県立脳血管研究センター(秋田脳研)を中心とする二つのグループによってほぼ同時に始められ、メーカーの協力によって1979年にそれぞれ第一号機が完成し、日本のPET研究がスタートした。以下に日本におけるPET装置開発のあゆみを紹介する。
※記事中の画像はクリックで拡大されます。
目次
- 当初の世界背景
- 放医研頭部用PET装置 (Positologica I)
- 秋田脳研PET/SPECT兼用装置 (Headtome I、II)
- 全身用多層型PET装置 (Positologica II、III)
- 放医研マウス用PET装置 (Positologica IV)
- 頭部/全身用PET装置 (Headtome III、IV)
- 高解像力頭部用PET装置 (SHR 1200、SHR 2400)
- 動物用PET装置 (SHR 2000、SHR 7700)
- ual-PET装置の試み (Headtome-V Dual)
- 解像力の推移
- 三次元PETへの移行
- 三次元PETのデータ補正と画像再構成
- 臨床PETの普及
- 最近の話題と今後の展開
1. 当初の世界背景
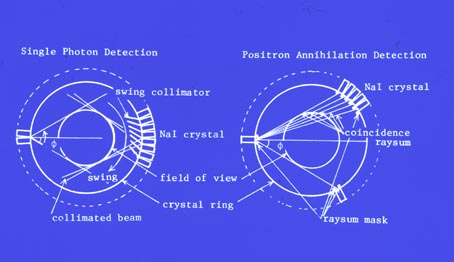
同時計数法を利用して生体内のポジトロン(陽電子)放出核種を画像化し、医学診断に役立てようという考えが示唆されたのは1950年代のことである。1960年代初期にはカルフォルニア大学ドナー研究所のH. O. Angerら[1]がアンガー型ガンマカメラと焦点検出器との同時計数を用いた装置を試作し臨床実験を行っている。1960年代後半から1970年代にかけて、マサチューセッツ総合病院のG. L. Brownellら[2]もNaI(Tl)結晶を多数二次元に配列した「多結晶検出器」を対向させて同時計数を計測するポジトロンカメラを開発して、臨床研究を行った。
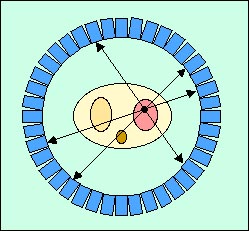
現在のPET装置のように検出器をリング状に配列したポジトロン断層映像装置の構想をはじめて実現したのは1962年ブルックヘブン国立研究所のS. Rankowitzら[3]であったが、当時は画像再構成法が未完成で十分な成果が得られなかった。1972年にG. N. HounsfieldらによってX線CTが開発され、CT画像再構成法が急速に進歩したが、このCT画像再構成法をとりいれたPET装置をはじめて報告したのは1975年ワシントン大学のM. M. Ter-Pogossianらのグループ[4]であった。この装置はPETT IIIとよばれ、48個のNaI(Tl)検出器を6角形状に配列したもので解像力はおよそ2 cmであった(図2)。この装置を改良して最初の商業機であるECAT(Ortec社)が開発された。また、1978年には4リング(7スライス)の装置PETT IV[5]が報告された。この頃からこれらの成功に刺激され、多くの研究機関や大学病院でPET装置の開発研究が行われ始めた。
2. 放医研頭部用PET装置 (Positologica I)
放医研では1960年代の末頃から新方式アンガー型ガンマカメラの開発研究(1970年頃)、多結晶横断シンチグラフ装置の開発研究(1973年頃)など核医学計測の研究が行われてきた。1970年代前半に医療用サイクロトロンが導入され、速中性子線など粒子線によるがん治療の研究が始められたが、これと並行してサイクロトロンで生産される短寿命のポジトロン放出核種を利用してポジトロン・イメージングの研究が開始された。ガンマカメラと多結晶焦点検出器の同時計数を用いたポジトロンカメラの研究(1976年頃)、多結晶二次元検出器対向型ポジトロンカメラ(写真1)の試作研究(1978年頃)が行われ、18Fを用いた全身骨スキャンの研究などに利用された。
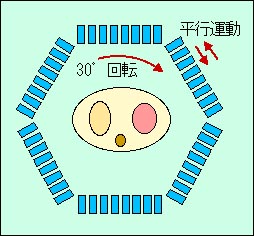
当時ポジトロン用検出器にはNaI(Tl)シンチレータが用いられていたが、1977年にカリフォルニヤ大学のZ. H. Choら[6]によってBGO(ゲルマニュウム酸ビスマス)がPET用の検出器として有用であることが報告された。ちょうどその頃、日立化成(株)ではX線CTへの利用を意図してBGOシンチレータが開発されていた。そこで放医研では日立メディコ(株)、日立製作所中央研究所および日立化成の協力で、BGOを用いた頭部用PET装置の開発を開始した。円形リング状のPET装置ではふつう検出素子を円周上に等間隔で配列するが、この装置ではBGO結晶を特殊な不均等間隔で配列し、その検出器リングを連続回転することによって測定投影データのサンプリング間隔を細かくし、解像力を向上する方法が採られた。この不均等な最適配列を見つける問題をPositology(ポジトロン・トポロジーの略)と称していたので、この方式のPET装置はPositology方式のカメラという意味で「Positologica」と名付けられた[7]。第1号機が完成し、稼動を始めたのは1979年11月であった。この装置の検出系は64個のBGO結晶(12x20x26mm)をリング状に配列したもので、コンパクトな1リングの装置であるが、解像力は約7mm(半値幅)で当時としては世界最高であった(写真2, 3)。 BGOを用いたPET装置としてはモントリオール神経研究所のPositome II(1979) [8]に少し遅れて世界で2番目である。
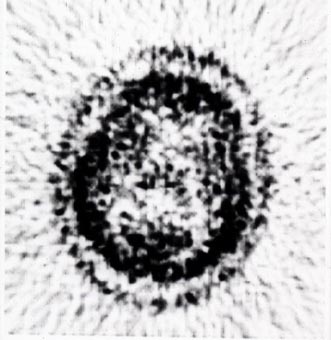
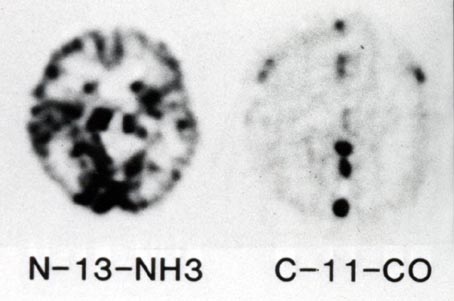
写真4は13N-NH3を用いて初めて得られた頭部のPET画像(未補正、ボランティアは館野之男先生)で、輪郭が二重に見えている。これは吸収・散乱の補正を行っていないために、頭骨の外側の皮膚の放射能が強調された結果であることがあとで判った。写真5はデータ補正を行った初期の画像である。
3. 秋田脳研PET/SPECT兼用装置(Headtome I、II)
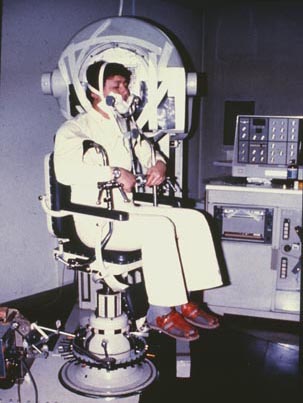
秋田脳研では1970年初期よりプローブ検出器やオートフルオロスコープ(モザイク結晶型ガンマカメラ)を用いた133Xeクリアランス法による局所脳血流量測定が行われた。1975年頃よりオートフルオロスコープと回転椅子を利用したSPECTの研究が開始され、三次元脳循環測定が試みられた(写真6)。
1978年秋頃より島津製作所の協力のもとに動態測定を目的としたユニークなアイデアのHeadtome I の開発が進められ[9]、放医研物理グループからのアドバイスも得て1979年に完成した。この装置は1リングの頭部用装置であるが、PETとSPECTを兼用できるのが最大の特徴であった。検出部は64個のNaI(Tl)結晶(16 x 28 x 70mm)をリング状に配列したもので、SPECT測定時にはタングステン板でできた特殊な振角コリメータが用いられた。この装置は頭部用トモグラフという意味とHybrid Emission Advanced DynamicTomographの頭文字から「Headtome」と名付けられた(写真7〜9)。
「写真7」Headtome I の外観。ガントリーは島津製、回路は秋田脳研製
「写真8」Headtome I はSPECT(左)とPET(右)の切り替えができた。
「写真9」Headtome I での133Xe脳血流測定の様子
この装置を3リングに発展させたHeadtome IIが1981年9月に完成し[10]、同年12月頃より日常臨床に利用され始めた(写真10)。この装置ではSPECT用コリメータも大きく改善され、視野中心に対する傾斜角がわずかずつ漸増あるいは漸減するようにタングステン板を埋め込んだドラム式コリメータを回転する方式が採用された。PET用には2種類のスライスセプタが用意され、高精度セプタでは3スライスの画像が、高感度セプタでは5スライスの画像が測定された。
4. 全身用多層型PET装置 (Positologica II、III)
1979〜1982年にかけて通産省医療福祉技術研究開発事業の一つとして、日立メディコ、日立製作所中央研究所、浜松ホトニクス(株)の3会社で構成される研究組合と放医研が協力して2台の全身用多断層のPositologica II、III が開発され、1台は放医研に(1982年2月)、もう1台は京都大学(1983年9月)に設置された。放医研のPositologica II(写真11) [11]は3リング(5スライス)の装置で、検出器には4個のBGO結晶を2本の光電子増倍管に結合し、ガンマ線を検出した結晶を二つの出力信号から電気的に弁別する「コーディング方式」が初めて用いられた(写真12) [12]。この方式は最近のPET装置にも広く用いられている二次元コーディング方式のブロック検出器の原型として評価されている。
また京都大学の Positologica III(写真13)は4リング(7スライス)の装置(PCTW-II)で[13]、検出器には一つのガラス容器に2つの独立した光電子増倍系を封入した、いわゆるDual-PMT(写真14) [14]が開発・利用された。なおこのDual-PMTはその後多くの海外のPET装置にも広く利用された。
5. 放医研マウス用PET装置 (Positologica IV)
放医研では1983年度に浜松ホトニクスの協力のもとに、世界初の小動物(マウス)用PET装置Positologica IV[15]が開発された(写真15)。小動物用では観察すべき臓器も小さいので、それだけ高い解像力が必要である。そのためこの装置には同社が特別に開発したゲート付き光電子増倍管(写真16) [16]が使用された。予算の関係もあって、検出器系以外の電子回路部は放医研の手作りであるが、当時としては世界最高の解像力(2.2〜3.6mm)が得られた(写真17)。

「写真15」放医研マウス用PET装置 (Positologica IV)の外観 (外装ケースを外した状態)
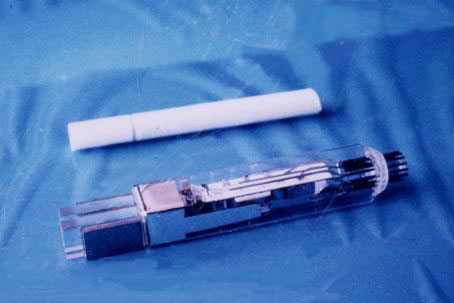
「写真16」ゲート付き光電子増倍管を用いた検出器
ゲート電極によって2つのBGO結晶の発光をパルス波形から弁別できる。
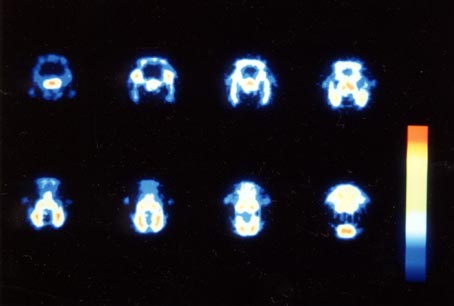
「写真17」この装置で得られたマウスのPET画像の一例
6. 頭部/全身用PET装置 (Headtome III、IV)
1983年、秋田脳研では島津製作所と協力してBGO検出器を用いた3リング(5スライス)のPET専用装置「Headtome III」を開発した[17]。この装置は全身測定用の固定したスライスセプタのほかに、頭部測定時には2種類の「内側セプタ」を挿入することができ、種々の軸方向解像力が得られるように工夫されている。断面内解像力は視野中心で7.9mmであが、各BGO検出器の前面にシャドウマスクを挿入することによってBGO検出器の開口幅を狭め、高解像力モード(解像力6.5mm)としても使用できるように設計されている。1983年当時世界最高の解像力の臨床画像を測定した(写真18)。
さらに1988年には4リングの全身用装置 Headtome IV[18]が開発された(写真19)。この装置には8個のBGO結晶(3 x 18 x 24mm)を2個の特殊な「Twist light guide」を経て前述のDual-PMTに結合したブロック検出器(写真20) [19]が用いられ、断面内解像力4.5mmが得られている。また、Headtome IVは動態解析を高速に行うための荷重積分法をハード的に組み込んだ初めての装置である。放射性トレーサ動態の速度定数が実時間で計測でき、PET本来の生理学的なパラメータ解析に大きな威力を発揮する設計が試みられた(写真21)。
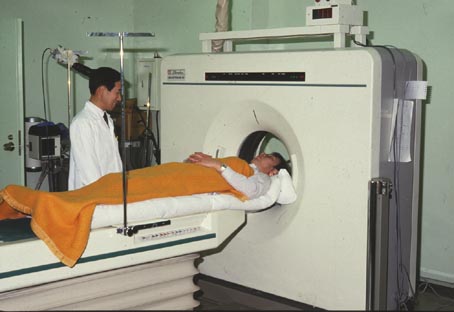
「写真19」Headtome IV の外観とその測定の様子

「写真20」Headtome IV のTwist light guideを用いたブロック検出器
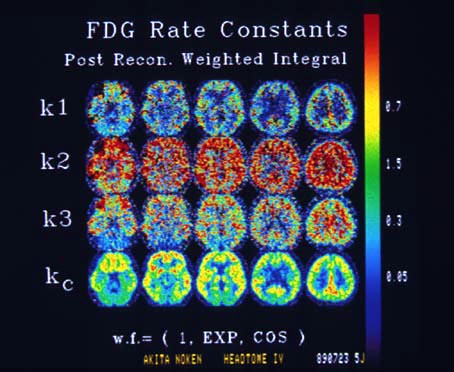
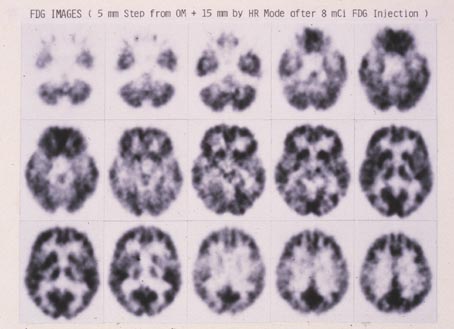
「写真21」Headtome IV で荷重積分法により実時間で計算されたFDGの速度定数画像
7. 高解像力頭部用PET装置 (SHR 1200、SHR 2400)
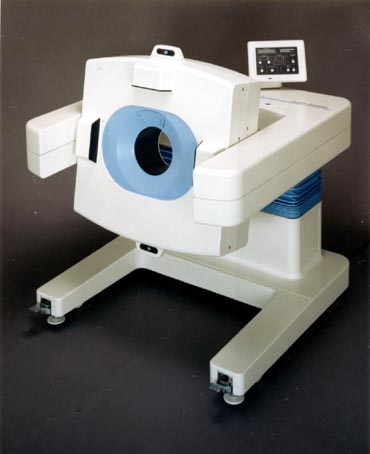
1986〜1989年、新技術開発事業団の開発委託事業として、ヒトの脳の高次機能の研究を目的とする高解像力の頭部用PET装置の開発が浜松ホトニクス(株)と放医研の協力で実施された(写真22) [20]。この装置には一つの小型ガラス容器に4個の独立した光電子増倍系が封入された特殊な光電子増倍管「Quad-PMT」が開発・使用された(写真23)。その結果視野中心で3.5mmの解像力が達成された。検出器リング数は5で、同時に9スライスの画像が得られる。同装置は1988年8月に完成して放医研に設置され、物理的性能の評価と臨床応用研究が行われた(写真24)。この装置はその後浜松ホトニクス(株)に返還され、BGO結晶の幅を半分にし、結晶数を2倍にすることによってさらに解像力の向上をはかり、半値幅2.7mmが達成された(SHR 2400)。その後、県西部浜松医療センター付属診療所に設置されてPET医療と研究に活用されている。
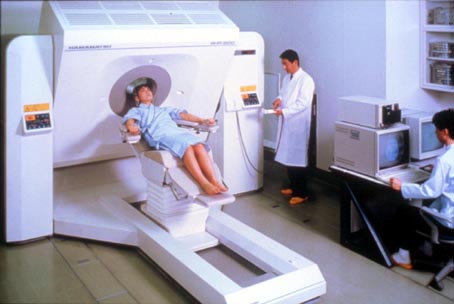
「写真22」高解像力頭部用PET装置 (SHR 1200)の外観

「写真23」SHR 1200に用いられたQuad-PMT
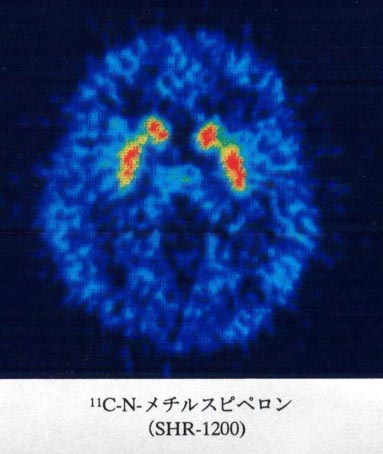
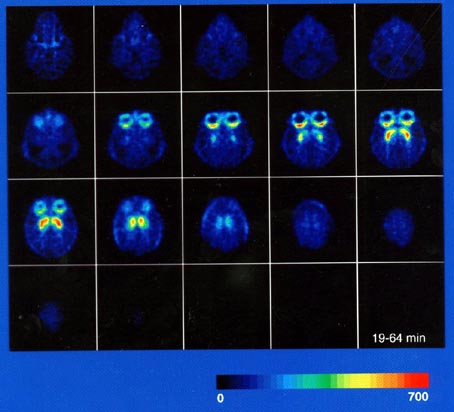
「写真24」SHR 1200で得られた画像(11C-Nメチルスピペロン)
被殻と線条体が初めて分離して描出できた。
8. 動物用PET装置
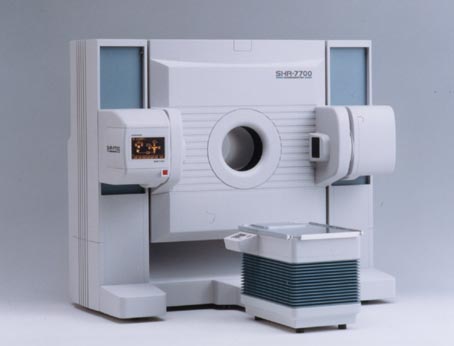
PET研究の進展とともに、マウス、サルなど小・中型動物を用いたPET研究の必要性が高まり、浜松ホトニクスにおいて動物用PET装置の開発と商品化が進められた。1990年に3インチ角形位置検出型光電子増倍管(PS-PMT)を用いたSHR 2000(4リング、解像力 3 mm) [21]、1996年にSHR 7700(16リング、解像力 2.6 mm) [22]が完成し、製品化された(写真25、26)。
SHR 7700 には新開発の超小型PS-PMTに4x8個のBGO結晶を結合した検出器ブロック(写真27)が240個採用されている。このPS-PMTは特殊なメタルチャンネル・ダイノードを使用し、28 mm角(高さ20 mm)のメタルパッケッジに封入された画期的な光センサーである[23]。写真28はこの装置で得られたサルの頭部画像である。
9. Dual-PET装置の試み (Headtome-V Dual)
秋田脳研では1994年にPET装置2台を縦列配置したDual-PET装置(Headtome-V Dual)が開発された(写真29、30) [24]。Dual-PET装置は脳と心臓の画像が同時に測定可能な、世界でも初めての試みである。2台のPET装置間のタイミングの同期やファイルの通信などに高度なソフト的な技術を必要とするが、PET測定で最も重要な生理学的なトレーサーのモデル解析の観点で左心室の放射能濃度を動脈血入力関数として代用することが可能である。Dual-PET装置は完全非侵襲定量測定を可能とするPETの歴史に新しいページを加えた装置で、脳循環と心臓循環の同時検査や放射性薬剤のトレーサー動態の同時測定に大きな威力を発揮すると期待されている。
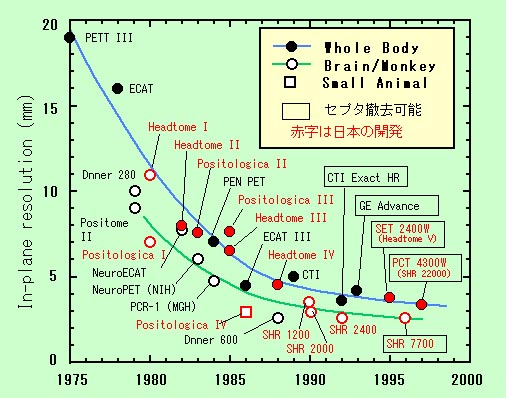
10. 解像力の推移
以上、おもに放医研または秋田脳研が関与して開発されたPET装置を中心に紹介した。これらの技術をもとに島津製作所(商品名:SET)と日立メディコ(商品名:PCT)が臨床用装置を、浜松ホトニクス(商品名:SHR)が動物用装置を製品化して、日本のPET研究に貢献してきた。図3は世界のおもなPET装置の断面内解像力の推移である。●は全身用、○は頭部用または猿など中型動物用、□はマウスなどの小型動物用である。赤字は日本で開発された装置である。1990年代初頭にかけて解像力が大きく向上したことが示されている。
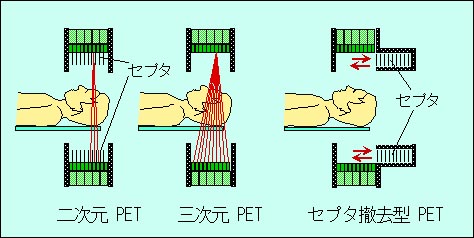
11. 三次元PET(3D-PET)への移行
1990年代前半までの装置はいわゆる二次元PET(2D-PET)で、検出器リング間にスライスセプタを有し、同時計数のデータ収集と画像再構成は二次元的に行われる。解像力の向上とともに体軸方向視野の増大と検出感度の向上が重要課題となり、1980年代の末頃より英国ハマースミス病院においてスライスセプタを撤去して三次元的なデータ収集と3D画像再構成を用いた、いわゆる3D-PETの研究が始められた[25]。3Dモードによって検出感度が大幅(5〜7倍)に向上するが、同時に散乱線による背景雑音もかなり増加し、その補正が困難で定量性に問題がある。そこで手動ボタンでスライスセプタを視野から撤去することによって3Dモードと2Dモードに切り替えて使用できる「セプタ撤去可能型PET装置」(図4)が米国CTI社によって開発され(ECAT 953B)、続いて全身用のCTI Exact、CTI Exact HR、GE Advanceなどが次々と製品化され、3Dモードにおける散乱・吸収補正など各種データ補正法の研究が行われてきた。日本でも島津SET 2400W (Headtome V)、浜ホトSHR 7700(動物用)[22]、日立メディコPCT 4300W (浜ホトSHR 22000)[26]、浜ホトSHR 12000(頭部用)[27]などのセプタ撤去可能型PET装置が相次いで製品化された(図3で四角の枠で囲った機種)。
12. 三次元PETのデータ補正と画像再構成
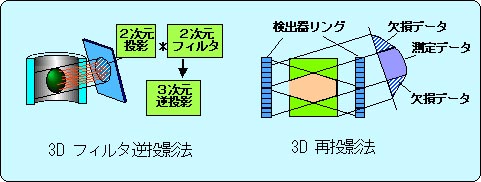
3D-PETでは、検出器リングの面から種々の角度で傾斜した方向に2Dの投影データが測定される。この軸方向への傾斜角の範囲(受容角)が視野全体亘って一定である場合には三次元フィルタ逆投影 (3D-FBP) 法[28]を用いて画像再構成することができる(図5左)。しかし現実の3D-PET装置では円筒状検出器の軸方向の長さが有限なため、図5右に示すように、大きい受容角で3D-FBP法を用いるには多くの投影データが欠損している。そこで、1990年代の初期に次のような再投影法(re-projection法)[29]が開発・利用された。すなわち、まず通常の2D-PETのように小さな傾斜角のデータのみを用いて3D画像を作成し、この3D画像(統計雑音は大きい)を大きい傾斜角の方向への投影を計算することによって前記の欠損データを推定する。このようにして、欠損データを計算で推定したデータで補った後、大きい受容角の3D-FBP法を利用して3D画像を得る。この方法は計算量が多いのが1つの欠点である。
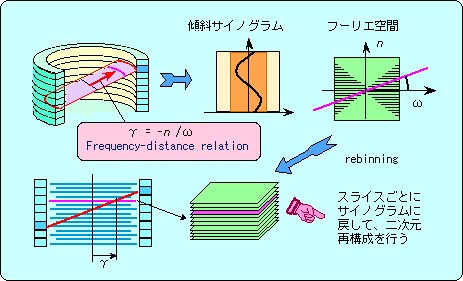
1995年に、ベルギーのM. Defriseがフーリエリビニング(Fourier rebinning, FORE)法[30]という巧妙な方法を提案した。このFORE法では、まず3D投影データを検出器リング面と傾斜した種々の角度へのサイノグラムとして収集する。この傾斜したサイノグラムを、フーリエ空間における「周波数と距離の関係」[31]を用いて、検出器面と平行な多数のサイノグラムに書き込む(図6参照)。この2Dサイノグラムから、スライス毎に通常の2D画像再構成法(たとえば2D-FBP法)を用いることによって3D画像が得られる。FORE法では3D逆投影の計算を必要としないので、計算時間は前記の再投影法より大幅(数十分の1)に短縮できた。
上記FORE法は一種の近似法で、受容角が大きい場合に視野周辺部で体軸方向の解像力が低下する欠点があった。1998年にE. TanakaとY. Amo[32]は投影の傾斜角に応じたハイパスフィルタを導入することによって体軸方向の解像力の低下が防げることを示した。1999年にM. DefriseらはFORE-J[33]と呼ばれるより正確な方法を発表したが、従来のFOREと比べて約2.5倍(2D再構成は除く)の計算時間を要する。
1982年に、L. A. Shepp とY. Vardi[34]がEM (expectation maximization) アルゴリズムと言われる逐次近似型の再構成法を報告して以来、EM法はPET画像の低放射能濃度領域の信号/雑音比を向上するのに有効であることが認められてきた。しかしEM法は収束が遅く、計算に膨大な時間を要するので、今日まで臨床に利用されることはなかった。 1994年になって、H. M. Hudoson と R. S. Lankin[35]がOS (ordered subset) EMアルゴリズムを発表して、EMアルゴリズムの計算速度を大幅に短縮することに成功した。このOSEM法では、すべての投影データをいくつかのサブセット(部分集合)に分割し、サブセットごとに画像が修正されるので、収束速度はサブセットの数(8〜16)にほぼ比例して向上する。そこでコンピュータの進歩とも相俟って、FORE(またはFORE-J)法と組み合わせたFORE + OSEM法が3D-PETの画像再構成の魅力的な方法として実用され始めた。
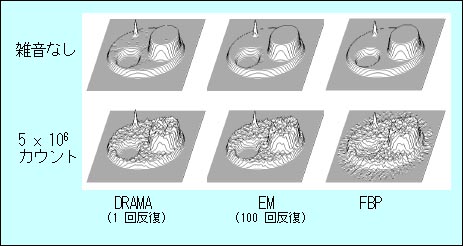
また、1996年にJ. Browneら[36]がRAMLA (row-action maximum likelihood algorithm)を提案した。この方法はOSEMでサブセット数を投影方向の数に等しくした特殊ケースに相当し、投影方向ごとに画像が修正されるが、統計雑音の過度の増大を避けるために緩和係数が導入されている。そのため良好な画像を得るには比較的小さい値の緩和係数を用いて数回以上の反復が必要である。2003年になって、E. Tanaka と H. Kudo[37]が「DRAMA (dynamic RAMLA)」という新しいアルゴリズムを発表した。このアルゴリズムはRAMLAに似ているが、投影データから画像への雑音成分の伝搬がすべての投影方向について均等であるように緩和係数を制御しているのが特徴である。1回(または2回)の反復で良好な画像が得られる(図7参照)。
3D-PETでは、ガンマ線の体内での散乱や吸収に対する適切な補正がきわめて大切で、種々の補正方法が開発されている。吸収補正には1〜3本の68Ge –68Gaの棒状線源を被写体の周囲に回転させながら2Dモードで透過スキャンを行って減弱係数の3D分布画像を求め、この画像から種々の方向への投影にたいする吸収補正係数を計算で求めるのが一般的である。透過スキャンの統計雑音の影響を少なくするために、上記の減弱係数を軟組織、骨、肺などの代表的な組織の減弱係数に振り分ける「セグメント法」[38]が用いられることもある。吸収補正に137Csの点線源を回転させる方法[39]やX線CTのデータを利用する方法もある。2000年頃から欧米ではX線CTとPETを一体化したPET/CT装置[40]が開発され、普及し始まった。CT画像はPETの吸収補正に利用されるのみでなく、PET画像に形態学的情報を付加するため臨床上きわめて有用である。
最近のほとんどのPET装置には、上記のようなデータ補正や画像再構成に必要なハードウェアとソフトウェアが組み込まれている。透過スキャンは放射スキャンの前に行うのがふつうであるが、被験者を長時間束縛する結果、被験者に与える負担が大きい。島津製作所の最近のモデル(SET-2000シリーズ、Headtome-V)では、透過スキャンを放射スキャンと同時に測定できるモード[41]が用意され、吸収補正による統計雑音を軽減するために減弱係数画像をエッジ保存型非直線ガウスフィルタで平滑する方法[42]が用いられている。また、全身測定では患者を乗せたベッドを体軸方向にステップ状に移動させて数カ所で測定するのが一般的であるが、上記の装置ではベッドを連続的に移動しながら測定でき、継ぎ目のない全身PET画像が効率よく得られる[43]。この装置の画像再構成法として、K. Kitamuraら(島津製作所)は従来のFOREを修正して傾斜角に依存した荷重でサイノグラムを加算する方式を用いたW-FORE法を開発し、さらに2003年には前述のハイパスフィルター[32]を導入したW-FORE-HPF法を開発し、通常のFOREと同等な計算時間で信号/雑音比および体軸方向解像力がFORE-Jよりも良好な結果が得られることを報告した[44]。
13. 臨床PETの普及
臨床用PET装置は放射線計測技術およびデータ処理技術の絶え間ない進歩によって発展を続けてきた。最近の20年間に解像力は半値幅にして10〜15 mmから3〜4 mmに向上し、検出効率も3Dモードの採用によって5〜6倍向上した。その間にPETの臨床的有用性が次第に認められ、とくに脳疾患、心臓疾患、がんの検診、良性/悪性腫瘍の判別、がん転移の検出、がん治療の効果判定・予後観察などに有効であることが認識されてきた。それに応じてPET施設の数も増大し、2003年7月現在、日本のPET施設の総数は約50に達した。PET装置の総数は動物用(10台)を含めて約70台で、そのうちおよそ40台は海外からの輸入である。 PET検査の保険適用については15O2ガスによる検査が1996年4月より、18F-FDG検査が2002年4月より認められた。
1996年10月には山中湖クリニックがPET、超音波、X線CT、MRI(磁気共鳴断層撮影)を利用した成人病検診を開始し、会員制で運用されている。その報告によると、2002年末までに6867人が計15537回受診し、がんの発見率はPET検査で見つかったもの1.27%、その他の検査(超音波、CT, MRI)によるものを含めると2.3%ときわめて高率であった[45]。その後、PET装置を導入した検診センターが各地に設置され始め、2004年1月現在、サイクロトロンを設置しているPET施設の総数は約58(研究のみを行っている施設も含む)と推定されている(PETサマーセミナーのPET施設一覧http://pet.jrias.or.jp/index.cfm/28,367,95,html)。
14. 最近の話題と今後の展開
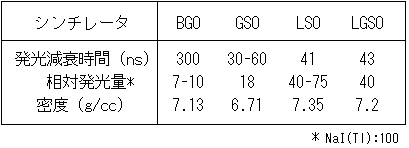
従来、ほとんどのPET装置の検出器にはBGO (Bi4Ge3O12)のシンチレータが用いられてきた。BGOは511 keVの消滅光子にたいして大きい阻止能を有するが、発光量が小さく、発光減衰時間が長いのが欠点であった。新しい高性能シンチレータの開発も進められ、CeをドープしたGd2SiO5 (GSO)、Lu2SiO5 (LSO)とそれらの混合結晶であるLGSOが注目され、利用されはじめている。これらのシンチレータの特性をBGOと比較して表1に示した[46]。
GSOは1983年に日立化成のK. Takagiら[47]によって初めて報告され、1995年にH. Ishibashiら[48]が大型単結晶の育成に成功した(写真31)。一方LSOはC. L. Melcherら[49],によって1992年に報告され、米国のCTI/Siemens社によって実用化された。LSOはGSOよりも発光量は多いが、エレルギー分解能は発光量から期待されるほど良くない。
位置検出型光電子増倍管(PS-PMT)の進歩も種々の医用画像計測に注目されている。浜松ホトニクス(HPK)では、金属ケースに封入された小型(28x28x20 mm)PS-PMT(写真27)に続いて、フラットパネル型PS-PMT[50]が開発された(写真32)。このPS-PMTのサイズは52x52x14.7mmで有効面積は49x49mmである。
2003年8月、720個のフラットパネル型PS-PMTを用いた高スループットPET装置(SHR 92000)が完成した[51, 52]。各PS-PMTには8x16個のBGO結晶(2.9x6.3x20mm)が結合されている(写真33、34)。この装置は6.4 mmピッチで96層の結晶リングを有し、体軸方向視野の長さは538 mmで、全身を2ステップの計測で十分カバーできる。また、散乱線の影響を軽減するために、8結晶リングごとに(57.6 mmのピッチで)粗いセプタが設けられている(写真35)。画像再構成にはFORE + DRAMAが用いられている。この装置は浜松PET検診センターに設置され、がんを含む成人病の検診に用いられている。

「写真33」高スループット全身用PET装置(HPK SHR 92000)の外観
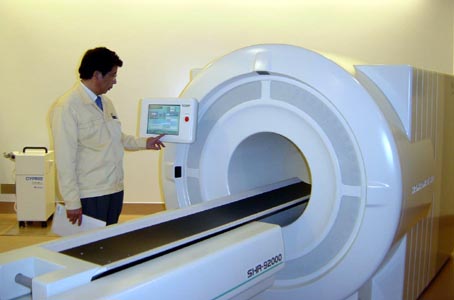
「写真34」全身用PET装置(HPK SHR 92000)のブロック検出器

「写真35」PET装置(HPK SHR 92000)に用いられている粗セプタ
高解像力PET装置で脳のイメージングを行う際の重要な問題は計測中に体動によって画像にアーチファクトが生じる場合があることである。ふつう頭部を固定する器具が用いられるが、頭部の固定は被検者に大きな負担を強いることになり、患者によっては固定器具が使用できない場合もある。国立循環器病センター研究所のH. Iidaらのグループ[53]は2002年に世界に先駆けて頭部用PETに体動補正システムを組み込むことに成功した。このシステムは6次元の体動情報を光学的な移動追尾ユニットで検出し、そのデータによって同時計数の情報を事象ごとに幾何学的に補正するものである(写真36)。体動補正の効果を写真37に示した。
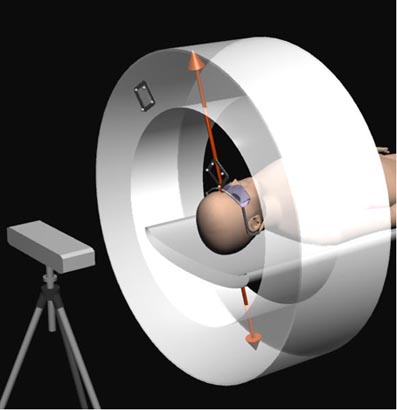
「写真36」体動補正システムを組み込んだ頭部用PET装置の概念図(H. Iidaら)
光学的移動追尾ユニット(図の左)から放射された赤外線は被検者の頭部に固定した標的から反射され、ユニット内の2台のCCDカメラで検出される。この標的には4個の反射板が取り付けられており、標的の位置と方向に関する情報(自由度6)が測定される。
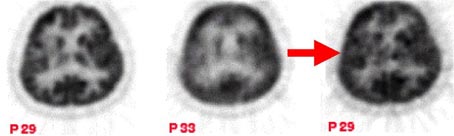
「写真37」正常ボランティアの脳のイメージに対する体動補正の効果
(左)頭部固定 (中)固定なし (右)体動補正後
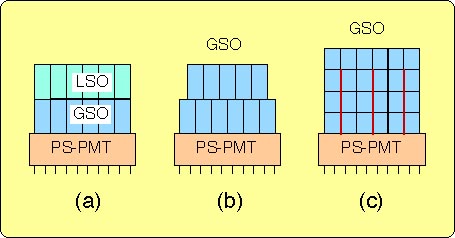
高感度・高解像力PETを実現する際のもう1つの問題は光子が検出素子に斜めに入射することによって空間分解能が低下することである。この現象は図8に示すように、光子が検出素子の種々の深さで検出されることに起因する。そこで、ブロック検出器に光子が検出された深さ(depth of interaction, DOI)の情報を持たせることによって視野全体にわたって高い解像力が実現できる。
DOI情報を持ったブロック検出器を実現する種々の方法が提案された(図9)。その一つは、図9(a)のように発光減衰時間の異なったシンチレータの層(セグメント)を重ねてPS-PMTに結合し、信号パルスの波形選別によって発光したセグメントを特定する方法である。シンチレータにはLSO, GSO, BGO, YSO などの組み合わせが考えられる。S. Yamamoto(神戸高専)ら[54]はGSO(Ce)の発光減衰時間がCe濃度に依存することに着目し、異なったCe濃度のGSO(Ce)結晶のブロックを用いることを提案した。T. Yamashita(HPK)ら[55]は図9(b)のように、シンチレータを2つのセグメントに分け、各セグメントを反ピッチずらせてPS-PMTに結合する方法を考案した。PS-PMTの出力からの重心演算によってこれらのセグメントが弁別でき、1ビットのDOI情報が得られる。また、H. Murayama (NIRS)ら[56]は図9(c)のようにシンチレータブロックの各セグメントにそれぞれ異なった光学的クロストークを持たせる方法を考案し、種々の構造のブロック検出器について良好なDOI情報を得ている[57]。
H. Murayama (NIRS)らは現在、国家プロジェクトとして複数の大学、研究機関、企業などと協力して、次世代PET装置に関する広範な基礎技術の研究開発を進めている。彼らは高感度・高解像力の脳研究用PET装置を試作する計画で、その検出器には4層のGSO結晶セグメントをフラットパネル型PS-PMTに結合して2ビットのDOI情報を持つブロック検出器を用い、DOI情報を活用したデータ補正法や画像再構成法などの総合的な研究を進めている。今後の成果が期待される。
(2004年2月記)
参考文献
[1] H.O. Anger, Survey of radioisotope cameras, Inst. Soc. Am. Trans., 5:311-334, 1966.
[2] G.L. Brownell and W.H. Sweet, Localization of brain tumors with positron emitters, Nucleonics, 11:40, 1953.
[3] S. Rankowitz, J.S. Robertson, W.A. Higinbotham, et al., Positron scanner for locating brain tumors, IRE Int. Conv. Rec., 9:49-56, 1962.
[4] M.E. Phelps, E.J. Hoffman, N.A. Mullani, et al., Design considerations for a positron emission transaxial tomograph (PETT III), IEEE Trans. Nucl. Sci., 23:516-522, 1976.
[5] M. M. Ter-Pogossian, N.A. Mullani, J.T. Hood, et al., A multislice positron emission computed tomograph (PETT IV) yielding transverse and longitudinal images, Radiology, 128:477-484, 1978.
[6] Z.H. Cho and M.R. Farukhih, Bismuth germanate as a potential scintillation detector in positron cameras, J. Nucl. Med., 18:840-844. 1977.
[7] N. Nohara, E. Tanaka, T. Tomitani, et al., Positologica: A positron ECT device with a continuously rotating detector ring, IEEE Trans. Nucl. Sci., 27:1128-1136, 1980.
[8] C.J. Thompson, Y.L. Yamamoto and E. Meyer, Positome II: A high efficiency positron imaging device for dynamic brain studies, IEEE Trans. Nucl. Sci., 26:583-589, 1979.
[9] I. Kanno, J. Uemura, S. Miura, et al., Headtome: A hybrid emission tomograph for single photon and positron emission imaging of the brain, J. Comput. Assist. Tomogr., 5:216-226, 1981.
[10] Y. Hirose, Y. Ikeda, Y. Higashi, et al., A hybrid emission CT - Headtome II, IEEE Trans. Nucl. Sci. 29:520-523, 1966.
[11] E. Tanaka, N. Nohara, T. Tomitani, et al., A whole-body positron emission tomograph; POSITOLOGICA II - Design and performance evaluation, Proc. 3rd World Congress of Nuclear Medicine and Biology, Paris Aug. 29 - Sept. 2., 1982.
[12] H. Murayama, N. Nohara, E. Tanaka, et al., A quad BGO detector and its timing and positioning discrimination for positron computed tomography, Nucl. Instr. Meth. 192:501-511, 1982.
[13] K. Okajima, K. Ueda, K. Takami, et al., Performance study of the whole-body, multiplayer positron computed tomograph - PCTW-II -, IEEE Trans. Nucl. Sci., 32:902-906, 1985.
[14] T. Yamashita, M. Itoh and T. Hayashi, New dual rectangular photomultiplier tube, In Proceedings of International Workshop on Physics and Engineering in Medical Imaging, IEEE Comput. Soc. 82CH1751-7, pp.209-211, Pacific Grove, 1982.
[15] T. Tomitani, N. Nohara, H. Murayama, et al., Development of a high resolution positron CT for animal studies, IEEE Trans. Nucl. Sci., 32:822-825, 1985.
[16] H. Murayama, E. Tanaka. N. Nohara, et al., Twin BGO detectors for high resolution positron emission tomography, Nucl Instr. Meth., 221:633-640, 1985
[17] I. Kanno, S. Miura, S. Yamamoto, et al., Design and evaluation of a positron emission tomograph: Headtome III, J. Comput. Assist. Tomog. 9:931-939, 1985.
[18] H. Iida, S. Miura, I. Kanno, et al., Design and evaluation of Headtome IV: a whole-body positron emission tomograph, IEEE Trans. Nucl. Sci., 36:1006-1010 1989.
[19] S. Yamamoto, S. Miura, S Iida, et al., A BGO detector unit for a stationary high resolution positron emission tomography, J. Comput. Assist. Tomogr., 10:851-855, 1986.
[20] T. Yamashita, H. Uchida, H. Okada, et al., Development of a high resolution PET, IEEE Trans. Nucl. Sci., 37:594-599, 1990.
[21] M. Watanabe, H. Uchida, H. Okada, et al., A high resolution PET for animal studies, IEEE Trans. Med. Imaging, 11:577-580, 1992.
[22] M. Watanabe, H. Okada, K. Shimizu, et al., A high resolution animal PET scanner using compact PS-PMT detectors, IEEE Trans. Nucl. Sci., 44:1277-1282, 1997.
[23] M. Watanabe, T. Omura, H. Kyushima, et al., A compact position-sensitive detector for PET, IEEE Trans. Nucl. Sci., 42:1090-109, 1995.
[24] H. Iida, S. Miura, I. Kanno, et al., A new PET camera for noninvasive quantitation of physiological functional parametric images, Headtome-V-Dual, In Quantitation of Brain Function Using PET, R. Meyer et al. (eds), California, Academic Press, pp.57-61, 1996.
[25] D.W. Townsend, T. Spinks, T. Jones, et al., Three dimensional reconstruction of PET data from multi-ring camera, IEEE Trans. Nucl. Sci., 36:1056-1065, 1989.
[26] S. Inoue, 10. Whole-body PET scanners PCT4300W and C-PET (Japanese), In Clinical PET Handbook, K. Torizuka et al. (eds), Institute for Techno-economics, pp.355-365, 2001.
[27] M. Watanabe, K. Shimizu, T. Omura et al, A new high-resolution PET scanner dedicated to brain research, IEEE Trans. Nucl. Sci., 49:634-639, 2002.
[28] J.G. Colsher, Fully three-dimensional positron emission tomography, Phys. Med. Biol., 25:103-115, 1980.
[29] P.E. Kinahan and J.G. Rogers, Analytic 3D image reconstruction using all detected events, IEEE Trans. Nucl. Sci., 36:964-968, 1989.
[30] M. Defrise, A factorization method for the 3D X-ray transform, Inverse Problems, 11:983-994, 1995.
[31] P.R. Edholm, R.N. Lewitt and B. Lindholm, Novel properties of the Fourier decomposition of the sinogram, Workshop on Physics and Engineering of Computerized Multidimensional Imaging and Processing, Proc, of the SPIE, 671:8-18, 1986.
[32] E. Tanaka and Y. Amo, A Fourier rebinning algorithm incorporating spectral transfer efficiency for PET, Phys. Med. Biol., 43:739-746, 1998.
[33] M. Defrise and X. Liu, A fast rebinning algorithm for 3-D positron emission tomography using John’s equation, Inverse Problems, 15:1047-1065, 1999.
[34] L.A. Shepp and Y Vardi, Maximum likelihood reconstruction for emission tomography, IEEE Trans. Med. Imaging, 1:113-122, 1982.
[35] H.M. Hudson and R.S. Larkin, Accelerated image reconstruction using ordered subsets of projection data, IEEE Trans. Med. Imaging, 13:601-609, 1994.
[36] J. Browne and A. De Pierro, A row-action alternative to the EM algorithm for maximizing likelihood in emission tomography, IEEE Trans. Med. Imaging, 15:687-699, 1996.
[37] E. Tanaka and H. Kudo, Subset-dependent relaxation in block-iterative algorithms for image reconstruction in emission tomography, Phys. Med. Biol., 48:1405-1422, 2003.
[38] M. Xu, P.D. Cutler and W.K. Luk, Adaptive segmented attenuation correction for whole-body PET imaging, IEEE Trans. Nucl. Sci., 43:331-336, 1996.
[39] R.A. de Kemp and C. Nahmias, Attenuation correction in PET using single photon transmission measurement, Med. Phys. 21:771-778, 1994.
[40] P.E. Kinahan, D.W. Townsend, T. Beyer, et al., Attenuation correction for a combined 3D PET/CT scanner, Med. Phys., 25:2046-2053, 1998.
[41] P.E. Kinahan, D.W. Townsend, T. Beyer, et al., Simultaneous emission and transmission measurements for attenuation correction in whole-body PET (Abstract), J. Nucl. Med., 36:1680-1688, 1995.
[42] K. Kitamura, H. Iida, M. Shidahara, et al., Noise reduction in PET attenuation correction using non-linear Gaussian filters, IEEE Trans. Nucl. Sci., 47:994-999, 2000.
[43] K. Kitamura, K. Tanaka and T. Sato, Implementation of continuous 3D whole-body PET scanning using on-the-fly Fourier rebinning, Phys. Med. Biol., 47:2705-2712, 2002.
[44] K. Kitamura, T. Mizuta, K. Tanaka, et al., A weighted Fourier rebinning method with high-pass filtering for continuous 3D scanning with a large aperture PET scanner, J. Nucl. Med., 44: 271, 2003.
[45] S. Yasuda, M. Ide, H. Fujii, et al., Application of positron emission tomography imaging to cancer screening, Brit. J. Cancer, 83:1607-1611, 2000.
[46] S. Yamamoto, Performance evaluation of LGSO scintillator PET application, Radioisotopes, 47:673-677, 1998.
[47] K. Takagi and T. Fukazawa, Appl. Phys. Letters, 42:43, 1983.
[48] K. Kurata, K. Kurashige, H. Ishibashi, et al., Scintillation characteristics of GSO single crystal grown under O2-containiing atmosphere, IEEE Trans. Nucl. Sci., 42:1034-1040, 1995.
[49] C.L. Melcher and J.S. Shweizer, A promising new scintillator: cerium-doped lutetium oxyorthosilicate, Nucl. Instr. Meth., 314:212-214, 1992.
[50] H. Kyushima, H. Shimoi, A. Atsumi, et al., The development of flat panel PMT, IEEE Nuclear Science Symposium Conference Record, 7-140, 2000.
[51] T. Hasegawa, E. Tanaka, T. Yamashita et al., A Monte Carlo simulation study on coarse septa for scatter correction in 3-D PET, IEEE Trans. Nucl. Sci., 49:2133-2138, 2002.
[52] M. Watanabe, K. Shimizu, T. Omura et al, A high throughput whole-body PET scanner using flat panel PS-PMTs, to be presented in 2003 IEEE/MIC.
[53] H. Watabe, N. Sato, Y. Kondoh, et al., Correction of head motion using optical motion tracking system during PET study with rhesus monkey, Brain Imaging Using PET, Academic Press, pp.1-7, 2002.
[54] S. Yamamoto and H. Ishibashi, A GSO depth of interaction detector for PET, IEEE Trans. Nucl. Sci., 45:1078-1082, 1998.
[55] H. Liu, T. Omura. M. Watanabe, et al., Development of a depth of interaction detector for g-rays, Nucl. Instr. Meth., Physics Research A 459:182-190, 2001.
[56] H. Murayama, H. Ishibashi, H. Uchida et al., Depth encoding multicrystal detectors for PET, IEEE Trans. Nucl. Sci., 45:1152-1157, 1998.
[57] N. Inadama, H. Murayama, T. Omura, et al., A depth of interaction detector for PET with GSO crystals doped with different amounts of Ce, IEEE Trans. Nucl. Sci., 49:629-633, 2002.